更新时间:2019-11-14 14:00点击:
医药网11月13日讯 显然,在国家医保局成立、带量采购推进和医保目录动态调整、DRGs细则出台、临床用药转向以价值医疗为导向等大背景下,此次医保谈判无疑被赋予了更多意义。政策对待医药创新的态度,以及创新药价格的形成机制,都将在此次谈判中明确的显现出来。而对于企业而言,接下来的努力方向,也已经十分明晰。
备受关注的新一轮国家医保谈判,在推迟了三个月之后,终于正式开始!
11月11日,多位行业人士向E药经理人证实,新一轮国家医保谈判已经正式开始。当天下午2点30分左右,朋友圈传出消息:杰华生物治疗乙肝的产品乐复能作为第一个通过新一轮医保谈判进入全国医保目录的品种,正式突围。这一消息在行业里也瞬间引发热议。
毫无疑问的是,价格谈判已经成为未来创新药进入国家医保目录的重要途径,也是创新药进入市场后第一时间需要考虑的准入方式。过去的医保目录谈判以及进入目录之后的市场放量表现已经证实了这一点。光大证券的研报显示,西藏药业的核心品种新活素 2019 年上半年销售额同比增长超过 60%,中国生物制药的安罗替尼 2019 年上半年快速放量估测贡献收入超过 13 亿元。整体来看,助力高临床价值品种药物通过医保目录实现快速放量的效果已经体现的非常明显。
而此次新一轮医保谈判较上一轮所涉及产品、厂家和治疗领域更多,谈判数量大,对于行业的影响无疑更加巨大。而对于谈判专家、政府、企业都是前所未有的挑战。
在国家医保局成立、带量采购推进和医保目录动态调整、DRGs细则出台、临床用药转向以价值医疗为导向等大背景下,此次医保谈判无疑被赋予了更多意义。政策对待医药创新的态度,以及创新药价格的形成机制,都将在此次谈判中明确的显现出来。而对于企业而言,接下来的努力方向,也已经十分明晰。
01 首个突围品种出炉,预示怎样方向?
11月11日下午2时30分左右传出消息,杰华生物此前所获批的用于治疗乙肝的一类生物新药重组细胞因子基因衍生蛋白注射液(商品名:乐复能)已顺利通过新一轮国家医保谈判,成为今年第一个通过谈判进入全国医保目录的品种。当天下午,杰华生物官网也发布新闻稿通报了这一消息。
乐复能成为第一个品种顺利进入医保很快在行业里引发了讨论。一方面,这是一个头顶诸多光环的“明星产品”,新闻稿显示,该药属于NCE类药物(New Chemical Entity),获得美国大分子新化合物专利授权,并曾先后列入国家“十一五”和“十二五”重大新药创新科技重大专项,被认为是“世界上近30年来发明的除核苷类抗病毒药物和人干扰素药物外的全新种类的慢性乙型肝炎治疗药物(First in Class)”。但与此同时,该药在行业里也一度面临诸多质疑,而这种质疑尤其体现在其作用机理以及临床数据上。
但抛开关于产品本身的争议不谈,乐复能顺利通过谈判,也正式标志着新一轮国家医保谈判开始进行。2019年8月20日,新版国家医保常规目录出炉,国家医保局同时表示:根据专家评审和投票遴选结果,初步确定将128个药品纳入拟谈判准入范围,包括109个西药和19个中成药。但值得注意的是,由于考虑因素复杂,工作量大,医保谈判工作已经较原定的时间(2019年8~9月)推迟了3个月,国家医保局方面组织了上万名专家,跨越临床专家、药学专家、医保管理专家、药物经济学专家等,也对企业提出了很高的要求。
这很大程度上是因为,此次谈判的药品所覆盖的,是癌症、糖尿病、肝病等重大疾病治疗领域,且均为临床价值较高但价格相对较贵的独家产品,许多产品都是都是近几年国家药监局批准的新药,亦包括国内重大创新药品。此前国家医保局也曾表示,“由于本次谈判品种较多、普遍对基金影响大等,本次谈判对成功率不作要求。”
9月2日一份国家医保目录药品谈判企业沟通会纪要流出。根据相关内容,2017~2018年按通用名计算共上市128个新药,除去10个已于2018年专项抗癌药谈判准入,18个新增2019年常规目录,70个新药进入此轮谈判,30个无缘准入。而据业内消息,70个进入谈判的品种中,包括4款PD-1产品(两个进口,两个国产)、丙肝新药索磷布韦韦帕他韦复方、PARP抑制剂奥拉帕利、肺动脉高压药物(多款PAH),阿柏西普/康柏西普、呋喹替尼、阿来替尼、仑伐替尼、依库珠单抗、CKD相关药物等等。
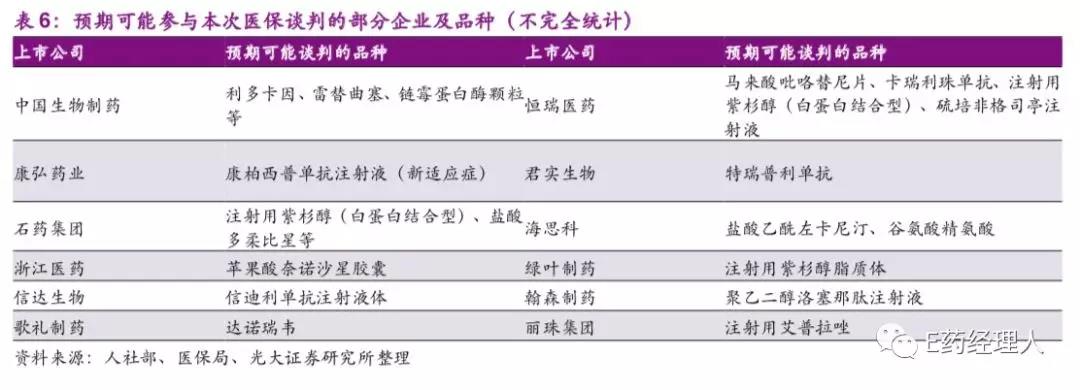
而据光大证券预测,接下来还会有一批重磅的品种加入到国家医保谈判中来,例如中国生物制药的利多卡因、雷替曲塞,康弘药业的康柏西普、石药集团的注射用紫杉醇、盐酸多柔比星等等。
而从谈判的流程上来讲,“价值”仍然是价格形成的关键因素。根据该纪要内容,现场谈判流程为医保放和企业方开展现场谈判,当场签字确认谈判结果;随机选定谈判品种,原则上竞品在一组谈判;每个品种30分钟,2次报价机会。“在谈判中,企业要有力着重突出产品的多维度价值,以获得满意的准入价格。”
事实上,“价值”首先包括药品的临床价值,需要通过临床研究证据论述。其次要从患者实际需要角度,考虑药品的患者价值,最后是药品经济价值,而药物经济学在我国尚是一个新兴领域。
国盛证券医药行业首席分析师张金洋在朋友圈发表评论称:其实这次创新药医保谈判主要看平均降幅,因为会反映两个态度:第一是对创新药的整体态度,第二是对国产创新药的特殊态度。对股价影响都是短期,未来都是放量,量都不会小,只是看付出的代价大小,反映医保局代表的政策决定集团整体对未来创新态度,进一步影响整体市场对创新的预期程度。
02 CDE“周五见”放大招:新药审评接力
短短几年时间,创新药研发链条上涉及到的审评审批、医保准入等环节都较之前有了巨大进步。药品集中带量采购的推行进一步加速医药行业结构改变,腾笼换鸟支持创新。可以明确看到国家对于创新药的支持。
11月8日,CDE在官网一口气发出7个公告,包含16个附件,长达10万多字。其中,关于《突破性治疗药物工作程序》和《优先审评审批工作程序》征求意见的通知、关于再次公开征求《临床急需药品附条件批准上市技术指导原则》意见的通知进一步完善优先审评审批政策,对鼓励和研发创新药物,加快具有临床价值和临床急需药品的研发上市有重大利好。
事实上,我国关于药品注册优先审评的相关政策最早自2005年就已经开始进行。据光大证券研报梳理,2005年11月8日出台的《药品特别审批程序》就已经开始涉及到优先审评,只是范围更多集中在国家进入紧急状态时,或突发重大公共卫生事件时。而一直到2017年12月18日《总局关于鼓励药品创新实行优先审评审批的意见》的出现,期间至少有七部文件都曾涉及过优先审评的事宜。
而到了2018年5月23日,卫健委《关于优化药品注册审评审批有 23 号 关事宜的公告》的发布,正式提出了“境外上市的防治严重危及生命且尚无有效治疗手段疾病以及罕见病药品可以提交境外取得的临床试验数据直接申报药品上市注册申请基于产品安全性风险控制需要开展药品检验工作并取消进口药品再注册核档程序。”
《2018年度药品审评报告》显示,2018年将313件注册药物纳入优先审评程序,其中儿童用药和罕见病用药占63件。
而本次关于优先审评审批的征求意见稿更加强调纳入突破性治疗药物、附条件批准上市注册的药品、临床急需的短缺药品、罕见病治疗药物、儿童用药、具有明显临床价值的创新疫苗等。该制度将进一步完善优先审评审批制度,形成正式工作程序。
其次是突破性治疗药物程序。突破性疗法认定由美国FDA首创,在鼓励创新药物研发和加速新药上市审批方面发挥了重要的作用。光大证券认为,此次意见稿公布的纳入突破性治疗药物程序,无论是适用范围还是认定条件都充分接轨国际,将加速治疗严重疾病或未满足治疗需求领域新药的审批。